Химические концепции в современном естествознании.
На атомном уровне нет различий между составом органических и неорганических веществ. Различия появляются между органическим и неорганическим миром на молекулярном уровне. Химия изучает молекулярный состав вещества и превращение веществ. Слово, предположительно, произошло от древнего названия Египта – Kham, или от греческого слова Khemia (сок растения).
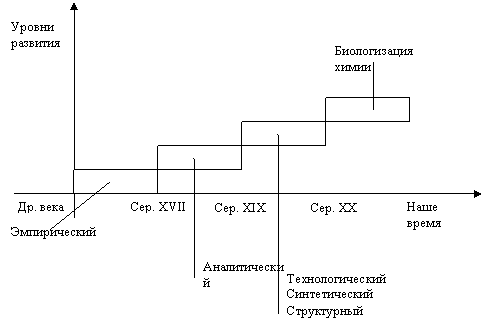
I. Эмпирический уровень – чисто прикладной характер. В Египте была известна металлургия, стеклоделие, гончарное дело, парфюмерия ( в том числе - бальзамирование), носителями знаний были жрецы. Египет был в I в н.э. завоеван Древним Римом, тогда император Диоклитиан приказал уничтожить все книги жрецов, которые занимались химией, так как он опасался появления много дешевого золота. Христианство загнало химию в подополье, так как химическое знание считалось язычеством. В VII веке до н.э. Египет был завоёван арабами, основали Османскую империю, где появились учёные, пытающиеся превратить металл в золото. Al-iksir (философский камень) – «эль-иксир». Химия превращается в алхимию. Авиценна (правители разрешили ему заниматься химией). В XII веке после распада Османской империи некоторые книги по алхимии попали в Европу и были переведены на латинский. До XVII века в Европе была алхимия (Ей занимались также Ньютон, Бойль). Парацельс занимался созданием лекарств из минералов. Бойль убрал приставку «ал», и алхимия стала химией. Он выпустил первую книгу по химии.
II. Аналитический период включает в себя три концепции:
1. Концепция простого и сложного вещества.
2. Концепция понятия химического соединения.
3. Концепция атомно-молекулярного учения (атомизма).
В эти два века химия оформилась как точная наука.
1. Концепция простого и сложного вещества. Теория флогистона, разработанная в XVII веке (Шталь), о том, что при горении руды металл из руды соединяется с флогистоном, находящимся в воздухе и образует сложное вещество. Если вещество прокалить без доступа воздуха, получается чистый металл. Эта теория объяснила процесс получения металла из руды. Теория флогистона умерла с появлением работа Лавуазье и Ломоносова в XVIII веке. Они опытным путём опровергли теорию. Лавуазье открыл кислород, но не успел закончить исследования, так как был четвертован во время Французской революции. Они по отдельности открыли закон сохранения массы – первый стехиометрический закон. Для химических реакций закон сохранения массы справедлив из-за недостаточной точности измерений.
2. Понятие химического соединения. Закон Пруста, который был опубликован в 1799 году, даёт соотношение между массами элементов, входящих в состав соединения, постоянно и независимо от способа получения соединения. В конце XIX века Курнаков расширил этот закон, открыв химические соединения, имеющие переменный состав. Например, Ag2Zn, FeS – бертоллиды (Бертолле); H2O - дальтониды (Дальтон).
3. Основные положения, разработанные Ломоносовым (1791) и Дальтоном (1798). Закон кратных отношений Дальтона: Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого элемента относятся между собой как небольшие целые числа. То есть, элементы, соединенные друг с другом в строго определенных весовых отношениях, соответствуют количеству их атомов в соединении. Были обозначены границы применимости: этот закон неприменим для изотопов. В дальнейшем большую роль сыграл периодический закон Менделеева (1869). Г. Мозли в 1910 подтвердил правильность таблицы Менделеева, проверив 86 первых элементов, установил, что порядковый номер совпадает с количеством протонов. Я. Берцелиус произвел в начале XIX века переворот в химии – разработал химическую символику.
III. Аналитический период ответил на вопрос о том, из каких атомов состоят молекулы и как эти атомы располагаются в пространстве. Берцелиус в 1807 году предложил считать вещества, характерные для живой природы, органическими, а для неживой – неорганическими. До 1828 году господствовала теория витализма – жизненная сила органических веществ. В 1828 году Вёлер получил из неорганического вещества органическое без всякой живой силы.
![]()
Было замечено, что в органические вещества входит углерод. Эмпирическая формула не отражает структурного строения C2H6O. Берцелиус в 1830 году назвал их изомерами.
|
|
H |
H |
|
|
H |
C |
C |
OH |
|
|
H |
H |
|
Франкланд в 1852 году выдвинул теорию валентности – способности атомов присоединять другие атомы. В 1862 году Бутлеров выдвинул теорию строения органических молекул.
1. Свойства органического соединения определяются их химическим строением, то есть, порядком соединения атомов между собой.
2. При определении реакционной способности органической молекулы необходимо учитывать взаимное влияние атомов в молекуле.
3. Структурные формулы объясняют существование изомеров:
А. Изомерия углеродного скелета.
Б. Изомерия положения кратной связи.
В. Геометрическая (цис-, транс-) изомерия.
Г. Зеркальная (хиральная) изомерия. (Правовращающие и левовращающие изомеры.